DERGİMİZ
DERGİ KAPAĞIMIZ
ÜNİTE 1 HÜCRE BÖLÜNMESİ VE KALITIM
MİTOZ BÖLÜNME:


Mitoz ana hücre'nin bölünerek iki yeni hücre oluşturmasına denir.
Genellikle ardından sitoplazma ve hücre zarının bölünmesi olan, sitokinez gelir. Bunun sonucu olarak, organelleri ve diğer hücre elemanları eş olan iki kardeş hücre oluşur. Mitoz ve sitokinez hücre döngüsünde M harfiyle gösterilen mitozu tanımlar. Mitoz yalnızca ökaryotik hücrelerde görülür. Çokhücrelilerde somatik hücrelerin oluşumu mitozla olurken, eşey hücrelerinin oluşumumayoz denilen bölünme çeşidiyle olur. Çekirdeği olmayan prokaryotlarda hücreler, fission denilen bölünme yöntemiyle bölünürler.
Zigot oluştuktan sonra başlayan mitoz bölünme, organizma belli bir büyüklüğe erişinceye kadar tüm soma hücrelerinde ve bazı hücrelerde (kemik iliği vb.) hayat boyu devam eder. Mitozda her hücrenin çekirdeğinde kromozomlar kendini eşler. Eşler, ana hücrenin bölünmesiyle oluşan iki yavru hücreye verilir. Böylece ana hücreye benzeyen, diploid sayıda (2n) kromozomlu iki yavru hücre meydana gelir. Mitoz da çekirdek bölünmesi karyokinez, sitoplazma bölünmesi sitokinez olarak tanımlanır. Karyokinez başlangıçta interfaz ve sonrasında gerçek bölünme evreleri olanprofaz, metafaz, anafaz ve telofaz olarak görülür.

Mitoz evreleri
Profaz
İnterfazda eşlenmiş durumdaki kromatinler kısalıp kalınlaşarak kromozoma dönüşürler. Çekirdek zarı, çekirdekçik ve organeller eriyerek tamamen kaybolur. Kromozomlar ekvatoral bölgeye hareket etmeye başlarlar.
Metafaz
Kardeş kromotitler ekvatoral düzlemde bir çember gibi, bazen de karışık olarak ekvatoral düzlem üzerinde dizilirler ve sentrozomlar interfazda oluşturmuş olduğu iğ ipliklerini kromozomlara doğru göndermeye başlar. Hücrenin ortasında hafif boğumlanma olur. İğ iplikleri kardeş kromatitlere tutunur. Kromozomların en net görüldüğü safhadır.
Anafaz
Kromozomlardaki sentromerlerin aynı anda ikiye bölünmesiyle kardeş kromatitler tam olarak birbirinden ayrılır. Kardeş kromatitler sentromerleriyle iğ ipliklerine tutunarak zıt kutuplara doğru harekete geçer. Anafaz evresi kardeş kromatitlerin zıt kutuplara ulaşmasıyla tamamlanır...
Telofaz
Profaz evresinde eriyen çekirdek zarı, çekirdekçik ve organeller yeniden oluşmaya başlar.Kutuplara çekilen kromatitler çekirdek zarının içine girerler.Kısaca bu evrede Profazda olan her şeyin tam tersi olur.Bu evreden sonra sitoplazma bölünmesi gerçekleşir.
Sitoplazma bölünmesi
Çekirdek bölünmesi gerçekleştikten sonra hayvan hücreleri ortadan boğumlanarak, bitki ve diğer çeperli ökaryotik hücreler ise orta lamel (ara lamel) ile bölünerek iki yeni hücre oluşturur.
Hayvan hücresindeki sitoplazma bölünmesi: Hücrenin ekvator bölgesinde dıştan içe doğru meydana gelen bir boğumlanma ile başlar. Bu boğumlanma sitoplazmayı ikiye ayırıncaya kadar devam eder. Yeni hücreler eşit veya eşit olmayan büyüklüktedir. Fakat genetik materyal bakımından her iki hücre de aynı genetik yapıya sahip, kromozom sayıları eşittir.
Bitki hücresindeki sitoplazma bölünmesi: Bitki hücresinde hücre çeperi bulunduğundan boğumlanma görülmez. Hücrenin ortasında orta lamel (ara lamel) denilen ara plak oluşumu başlar. Orta lamel hücrenin çeperine ulaşıncaya kadar büyür ve kalınlaşır. Böylece sitoplazma içindeki yapılar hemen hemen eşit olacak şekilde ikiye ayrılır. Zamanla orta lamel iki yavru hücrenin faaliyeti sonunda normal hücre çeperi halini alır. Sitoplazmanın da bölünmesiyle aynı genetik bilgiye sahip iki yavru hücre oluşur.
Hayvan ve bitki hücrelerinde mitoz bölünme farklılıkları
- Hayvan hücrelerinde sitoplazma boğumlanarak bölündüğü halde bitki hücresinde orta lamel (ara lamel) oluşumuyla gerçekleşir.
- Bitki hücresinde iğ ipliklerini sitoplazma hazırlarken hayvan hücrelerinde bunu sentrozomlar yapar.
MAYOZ BÖLÜNME :

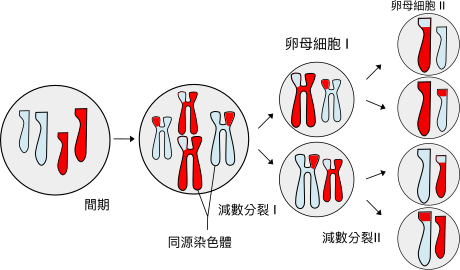
Mayoz Bölünme bir diploit ökaryotik hücrenin bölünerek genelde gamet olarak adlandırılan haploit hücrelere bölündüğü hücresel bir süreçtir. Gamethücresinde kromozom sayısının azalmasıyla sonuçlanan "mayoz", Yunanca'da "Daha da küçültmek" anlamına gelen Meioun kelimesinden gelmektedir. Mitoz bölünme ile alakası yoktur. Mayoz Bölünme eşeyli üreme için gereklidir ve bu yüzden eşeyli üreyen tek hücreli organizmalar da dâhil tüm ökaryothücrelerde görülür. Özellikle Bdelloid rotiferlerin içinde bulunduğu birkaç ökaryot mayoz yeteneklerini kaybedip partenogenezle ürerler. Mayoz eşeysizmitotik bölünmeyle üreyen arkealarda ya da prokaryotlarda meydana gelmez
Mayoz sırasında kromozom içinde paketlenmiş olan uzun DNA segmentlerinden oluşan diploit üreme hücresinin genomu DNA replikasyonundan sonra iki bölünme geçirerek gamet olarak adlandırılan haploit hücreleri oluştururlar. Her gamet kromozomların bir setini ya da orijinal hücrenin genetik içeriğinin yarısını içerir. Oluşan bu haploit hücreler diğer cinsin haploit hücreleriyle ya da döllenme sırasında yeni bir hücre olan zigotu oluşturmak için birleşebilirler. Bu yüzden mayozun bölünme mekanizması döllenme sırasında birleşen iki genom ile eşteş bir olaydır çünkü her ebeveynden gelen kromozomlar mayoz sırasında genetik rekombinasyona uğrarlar. Dolayısıyla her gamet ve sonuç olarak her zigot kendi DNA'sında kendine özgü bir İz/Tasarım taşıyacaktır. Diğer bir değişle, mayoz ve eşeyli üreme genetik varyasyonu oluşturur.
Mayoz, kromozomların yeniden dağılımını gerçekleştirmek için mitoz sırasında gerçekleşen aynı biyokimyasal mekanizmaları kullanır. Mayoza özgü birçok özellik bulunmaktadır. Bunlardan en önemlisi homolog kromozomlar arasında meydana gelen eşleşme ve genetik rekombinasyondur.
Mayozda da mitozda olduğu gibi profaz, metafaz, anafaz ve telofaz olarak adlandırılan dört evre vardır. Bu evreler arada interfaz olmaksızın peş peşe iki kez gerçekleşir ve sonuçta genetik özellikler bakımından 2 çeşit dört yavru hücre meydana gelir. Mayoz bölünme ile mitoz bölünme arasındaki en büyük farka profazda rastlanır. Mayoz bölünme iki aşamada gerçekleşir. Bu aşamalar, Mayoz-1 ve Mayoz-2 olarak adlandırılır.
Profaz I DNA ipliklerinin kısalıp kalınlaşmaya başlaması ile başlar. Bu evre sınırları kesin olmayan 5 evreye ayrılıp incelenir. Bu evreler;
Leptoten: Kromozomların mikroskopla seçilebildikleri andan itibaren başlar. İki eş kromatit birbirine sarılı halde bulunur. Ayrıca kromatinler üzerinde kromomer denilen ve koyu boyanan bölgeler fark edilir.
Zigoten: Biri anneden diğeri babadan gelen ve birbirlerine benzeyen homolog kromozomlar yan yana gelerek eşleşmeye başlarlar.Bu eşleşme bir uçtan diğer uca doğru devam eder. Bu evrede her biri iki kromatit taşıyan iki kromozomun yan yana durmasıyla sanki canlı n sayıda kromozom taşıyormuş gibi görülür. Görülen bu yapıya tetrat denir.
Pakiten: Homolog kromozomların eşleşmesi tamamlanır ancak kromozomlar kısalmaya devam eder. Ayrıca bu evrede mitozdan farklı olarak tetratlar arasında genetik madde alışverişi olur. Buna krossing-over denir. Bu olay homolog kromozomların birbiri üzerine çakışan (kiyazma "chiasma") kısmında gerçekleşir.
Diploten: Kromozomların sentromerleri ayrılmamıştır. Dört kromatit için iki sentromer vardır. Tetrat'taki homolog kromozomlar birbirinden ayrılmaya başlar. Ancak kiyazma bölgelerinde ayrılma olmaz ve kiyazmalar uca doğru kaymaya başlar.
Diakinez:Kromozomlar son halini alır. Çekirdekçik kaybolur. Çekirdek zarı parçalanır.
Metafaz I
Homolog kromozomlar ekvatoral plak üzerinde karşılıklı dizilir. Her kromozom sentromeri ile iğ ipliklerine tutunur.
Anafaz I
Homolog kromozomlar birbirinden ayrılarak zıt kutuplara ilerler.
Telofaz I
Hücrenin iki kutbunda bulunan kromozomlar uzayıp incelmeye başlar. Etraflarında çekirdek zarı oluşur. Sitoplazmanın boğumlanmasıyla da haploid sayıda kromozoma sahip iki yavru hücre oluşur.
Hayvansal hücrelerde: Çekirdek bölünmesi tamamlandıktan sonra sitoplazma ortadan boğumlanarak ikiye bölünür ve iki ayrı hücre oluşmuş olur.
Bitkisel hücrelerde: Oluşmuş olan iki çekirdekli hücrenin ortasında bir orta lamel (ara lamel) oluşur ve hücre duvarına kadar ulaşır. Dolayısıyla birbirine bitişik iki hücre oluşur. Hücrenin iki kutbunda bulunan kromozomlar uzayıp incelmeye başlar. Etraflarında çekirdek zarı oluşur. Sitoplazmanın boğumlanmasıyla da haploid sayıda kromozoma sahip iki yavru hücre oluşur.
Buraya kadar geçen olaylar mayoz-I olarak adlandırılır. Bundan sonra mitozdakinin aksine arada interfaz evresi olmaksızın profaz-II'nin başlamasıyla mayoz-II başlar. Mayoz-II mitoz bölünmenin hemen hemen aynısıdır. Hücrelerdeki haploid kromozom sayısı korunarak profaz-II, metafaz-II, anafaz-II ve telofaz-II gerçekleşerek mayoz bölünmenin sonunda n kromozom sayısına sahip 4 yavru hücre meydana gelir.
ÜNİTE 1 KONU 2 DNA VE GENETİK KOD

DNA
Deoksiribonükleik asit veya kısaca DNA, tüm organizmalar ve bazı virüslerin canlılık işlevleri ve biyolojik gelişmeleri için gerekli olan genetik talimatları taşıyan bir nükleik asittir. DNA'nın başlıca rolü bilginin uzun süreli saklanmasıdır. Protein ve RNA gibi hücrenin diğer bileşenlerinin inşası için gerekli olan bilgileri içermesinden dolayı DNA; bir kalıp, şablon veya reçeteye benzetilir. Bu genetik bilgileri içeren DNA parçaları gen olarak adlandırılır. Ama başka DNA dizilerinin yapısal işlevleri vardır (kromozomların şeklini belirlemek gibi), diğerleri ise bu genetik bilginin ne şekilde (hangi hücrelerde, hangi şartlarda) kullanılacağının düzenlenmesine yararlar.
Kimyasal olarak DNA, nükleotit olarak adlandırılan basit birimlerden oluşan iki uzun polimerden oluşur. Bu polimerlerin omurgaları, ester bağları ile birbirine bağlanmış şeker ve fosfat gruplarından meydana gelir. Bu iki iplik birbirlerine ters yönde uzanırlar. Her bir şeker grubuna baz olarak adlandırılan dört tip molekülden biri bağlıdır. DNA'nın omurgası boyunca bu bazların oluşturduğu dizi, genetik bilgiyi kodlar. Protein sentezi sırasında bu bilgi, genetik kodaracılığıyla okununca proteinlerin amino asit dizisini belirler. Bu süreç sırasında DNA'daki bilgi, DNA'ya benzer yapıya sahip başka bir nükleik asit olan RNA'ya kopyalanır. Bu işleme transkripsiyon denir.
Hücrelerde DNA, kromozom olarak adlandırılan yapıların içinde yer alır. Hücre bölünmesinden evvel kromozomlar eşlenir, bu sırada DNA ikileşmesigerçekleşir. Ökaryot canlılar (yani hayvan, bitki, mantar ve protistalar) DNA'larını hücre çekirdeği içinde bulundururken prokaryot canlılarda (yani bakteri vearkelerde) DNA, hücre sitoplazmasında yer alır. Kromozomlarda bulunan kromatin proteinleri (histonlar gibi) DNA'yı sıkıştırıp organize ederler. Bu sıkışık yapılar DNA ile diğer proteinler arasındaki etkileşimleri düzenleyerek DNA'nın hangi kısımlarının okunacağını kontrol eder.
GENETİK KOD:
A:ADENİN
T:TİMİN
C:SİTIZİN
G:GUANİN
ADENİN SAYISI TİMİNE VEYE TİMİN SAYISI ADENİN SAYISINA EŞİT İKEN GUANİN SİOZİNE VEYA SİTOZİN GUANİNE EŞİTTİR.


Genetik kod, genetik malzemede (DNA veya RNA dizilerinde) kodlanmış bilginin canlı hücreler tarafından proteinlere (amino asit dizilerine) çevrilmesini sağlayan kurallar kümesidir. Kod, kodon olarak adlandırılan üç nükleotitlik diziler ile amino asitler arasındaki ilişkiyi tanımlar. Bir nükleik asit dizisindeki üçlü kodon genelde tek bir amino asidi belirler (ancak bazı durumlarda farklı konumlarda bulunan aynı kodon üçlüsü, çevredeki bağlamla ilişkili olarak iki farklı amino asidi kodlayabilir).[1] Genlerin çok büyük bir çoğunluğu aynı kodla şifrelendiği için (bkz. RNA kodon tablosu), özellikle bu koda kuralsal veya standart genetik kod olarak değinilir, ama aslında pek çok kod varyantı vardır. Yani, standart genetik kod evrensel değildir. Örneğin, insanlarda,mitokondrilerdeki protein sentezi kuralsal koddan farklı bir genetik koda dayalıdır.
Canlılardaki genetik bilginin yalnızca genetik kod aracılığıyla depolandığı zannedilmemelidir. Tüm organizmaların DNA'sında düzenleyici diziler, genler arası diziler, kromozomal yapı bölgeleri bulunur, bunlar fenotipe büyük oranda katkıda bulunsa da kodon-amino asit ilişkisinden daha farklı kurallar ile etkilerini gösterirler (bakınız epigenetik).
ÜNİTE 2 KUVVET VE HAREKET
KALDIRMA KUVVETİ
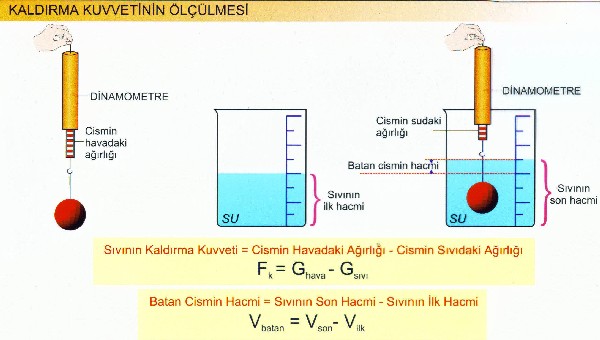
Bir cismi hava yerine suyun içinde kaldırmak istersek suyun içinde daha küçük bir kuvvetle kaldırabildiğimizi görürüz.Aynı şekilde dinamometrenin suyun içindeki ölçtüğü değer, havadakine
göre daha azdır.Bunun sebebi, suyun cisme yukarı yönlü, ağırlığı hafifletici bir kuvvet uygulamasıdır.
Suyun kaldırma kuvvetini Archimedes isimli bilim adamı bulmuş olup, Archimedes prensibi diye de anılır.Aslında bütün sıvılar, içindeki cisimlere yukarı yönlü kuvvet uygular. Bu kuvvet daima yerden yukarı yönlü bir kuvvettir.
Kaldırma kuvveti Fk sembolü ile ifade edilir.Vektörel bir büyüklüktür.
Kaldırma Kuvveti:Sıvı içinde bulunan cisimlere sıvı tarafından yukarı yönlü uygulanan kuvvete kaldırma kuvveti denir.
Kaldırma kuvveti; cisim etrafından yeri değiştirilen sıvının ağırlığına eşittir.Birimi Newton ve dyn dir.
G:Cismin Ağırlığı
Fk:Kaldırma Kuvveti
Kaldırma kuvvetinin büyüklüğü şunlara bağlıdır:
1)Cismin batan kısmının hacmine(Vb)
2)Sıvının yoğunluğuna (ds)
3)Ortamın çekim ivmesine (g)
bağlıdır.
Kaldırma : (Cismin batan) . (Sıvının ) . (Yer çekimi)
Kuvveti hacmi yoğunluğu ivmesi
Fk = Vb . ds . g
İle ifade edilir.
Fk: Newton
Vb: m3
ds: kg/m3
g: N/kg
NOT: Kaldırma Kuvveti hesaplanırken bu dönüşüm formülü kullanılır.
Fk=Vb .ds . 0.01
BASINÇ
Basınç, bir yüzey üzerine etkide bulunan dik kuvvetin, birim alana düşen miktarı. Katı, sıvı ve gazlar ağırlıkları nedeniyle bulundukları yüzeye bir kuvvet uygularlar. Kuvvetin kaynağı ne olursa olsun birim yüzeye dik olarak etki eden kuvvete basınç (P), bütün yüzeye dik olarak etki eden kuvvete de basınç kuvveti (F) denir.

- P : Basınç
- F : Kuvvet
- S : Alan
Katılarda basınç
Katı maddeler ağırlıklarından dolayı bulundukları zemine kuvvet uygularlar. Bu nedenle katıların bulundukları zemine uyguladıkları basınç oluşturan dik kuvvet, ağırlıklarıdır. Uygulanan kuvvet ve yüzey alanı değiştirilerek basınçın büyüklüğü değiştirilebilmektedir. Katılar kendilerine uygulanan kuvveti yönü ve şiddetini değiştirmeden aynen iletir. Bazı durumlarda yüzey alanı artırılarak basınç etkisi azaltılmaya çalışılır. Birim zamanda birim noktaya uygulanan kuvvet olarak tanımlayabilir.
Kapalı gaz basıncı
Gazlarda basınç ise birçok unsurla bağlantılıdır. Gazların basıncının hesaplanmasında sıcaklık, bulunduğu kabın hacmi, gazın miktarı ve R sayısı önemlidir. Bunları formülle ifade edecek olursak; P.V=n.R.T Gazlarda basınç, gazın molekül sayısı ve sıcaklığı artarsa artar; gazın bulunduğu kabın hacmi artarsa azalır. R sayısı ise sabit bir sayıdır. Kapalı gazlarda basınç manometreler yardımı ile ölçülür.
Sıvılarda basınç
Sıvı basıncı, sıvının ağırlığından dolayı bulunduğu kabın her noktasına uyguladığı basınçtır. Sıvı basıncı o noktanın sıvı sütununun ağırlığı kadardır. Yani, P=hxd (sıvı basıncı=yükseklik x yoğunluk). Sıvı basıncı kabın biçimine ve genişliğine bağlı değildir.

Basınç birimleri
| paskal (Pa) | bar (bar) | atmosfer (atm) | tor (Tor) | |
|---|---|---|---|---|
| 1Pa | ≡ 1 N/m2 | 10−5 | 9.8692×10−6 | 7.5006×10−3 |
| 1bar | 100,000 | ≡ 106 dyn/cm2 | 0.98692 | 750.06 |
| 1atm | 101,325 | 1.01325 | ≡ 1 atm | 760 |
| 1Tor | 133.322 | 1.3332×10−3 | 1.3158×10−3 | ≡ 1 Torr; ≈ 1 mmHg |
Örneğin: 1 Pa = 1 N/m2 = 10−5 bar = 9.8692×10−6 atm = 7.5006×10−3 tor
Fizik problemlerinde genellikle basınç birimi olarak, "Pascal (birim)" kullanılır.
ÜNİTE 3 MADDENİN YAPISI VE ÖZELLİKLERİ
PERİYODİK SİSTEM İ TANIYALIM
Periyodik tablo kimyasal elementlerin sınıflandırılması için geliştirilmiş tablodur.Dilimizde periyodik tablo, periyodik cetvel, periyodik çizelge, elementler tablosu gibi birçok şekilde isimlendirilmiştir. Bu tablo bilinen bütün elementlerin artan atom numaralarına (buna proton sayısı da denir) göre bir sıralanışıdır. Periyodik cetvelden önce de bu yönde çalışmalar yapılmış olmakla birlikte, icadı genellikle Rus kimyager Dimitri Mendeleyev'e maledilir. 1869'da Mendeleyev, tabloyu, atomların artan atom ağırlıklarına göre sıralandıklarında belli özelliklerin tekrarlanıyor olmasından oluşturmuştur.
Genel bakış
Genel bakış
| Grup → | 1A | 2A | 3B | 4B | 5B | 6B | 7B | 8B | 8B | 8B | 1B | 2B | 3A | 4A | 5A | 6A | 7A | 8A | |||||||||||
| ↓ Periyot | |||||||||||||||||||||||||||||
| 1 | 1 H |
2 He |
|||||||||||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
|||||||||||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
|||||||||||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
|||||||||||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
|||||||||||
| 6 | 55 Cs |
56 Ba |
57 71 |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
|||||||||||
| 7 | 87 Fr |
88 Ra |
89 103 |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Uut |
114 Fl |
115 Uup |
116 Lv |
117 Uus |
118 Uuo |
|||||||||||
| Lantanitler | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
||||||||||||||
| Aktinitler | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
||||||||||||||
|
|||||||||||||||||||||||||||||
Grup, periyot ve bloklar
Grup
Dış katman elektron dizilimi aynı olan elementlerin oluşturduğu birliğe grup denir. Gruplar periyodik tablodaki sütunlardır. Aynı gruptaki elementlerin kimyasal özellikleri aynıdır.
Gruplar iki şekilde adlandırılır. Birincisi IUPAC'ın önerdiği 1'den 18'e kadar olan sayılardır. İkincisi ise daha sık kullanılan harf (A,B) ve rakamlardan oluşan adlandırmadır.
| Grup | İsmi |
|---|---|
| 1 | alkali metal |
| 2 | toprak alkali metal |
| 13 | bor grubu |
| 14 | karbon grubu |
| 15 | azot grubu |
| 16 | kalkojen |
| 17 | halojen |
| 18 | soygaz |
Periyot
Periyodik tablodaki satırlara periyot denir. Toplam yedi periyot vardır. Altıncı periyot 32 elemente sahip uzun bir periyottur, bu periyodun 14 elementi aşağıya taşınmıştır. Bunlara lantanit denir. Aynı şey yedinci periyot için de geçerlidir. Yedinci periyottan ayrılan bölümlere ise aktinit denir.
Blok
Elementler -hidrojen ve helyum dışında- değerlik orbitallerine göre s,p, d ve f olmak üzere dört ana bloğa ayrılır. s ve p ana grup, d ve f yan grup olarak bilinir.
| f bloğunun altta olduğu bilindik görünüm (sol) f bloğu asıl yerine taşındığında oluşan görünüm (sağ) | |
Düzenli değişimler
Periyodik tabloda soldan sağa ya da yukarıdan aşağı gidildikçe düzenli değişen birtakım özellikler vardır.
Atom yarıçapı
Atomların büyüklüğü ölçülürken Van der Waals yarıçapı dikkate alınır. Çekirdekle dış katmanlarda bulunan elektronlar arasındaki çekim kuvveti ne kadar büyük olursa atom yarıçapı da o kadar küçük olur. Örneğin ikinci periyot elementlerinden lityumun son katman elektronu 3 protonla çekilirken, florunki 9 proton tarafından çekilir. Bu yüzden soldan sağa gidildikçe yarıçap azalır.
Yukarıdan aşağı gidildikçe dış katman elektronları çekirdekten daha uzakta bulunur. Atom yarıçapı artar.
İyonlaşma enerjisi
Gaz halde bulunan bir atomdan bir elektron koparmak için gereken enerjiye iyonlaşma enerjisi denir. Soldan sağa gidildikçe çekirdekle son katman elektronları arasındaki çekim kuvveti artacağından iyonlaştırmak için daha fazla enerjiye gerek vardır. O yüzden soldan sağa gidildikçe düzenli olarak artış beklenir ancak 2A ve 5A elementlerinin küresel simetrik özelliğinden dolayı sıralamada yerleri farklıdır.
- 1A<3A<2A<4A<6A<5A<7A<8A
Bir elektronu uzaklaştırmak için gereken enerji, elektronun çekirdekten uzaklığına bağlıdır. Bu sebeple yukarıdan aşağı inildikçe atom yarıçapı arttığından iyonlaşma enerjisi azalır.
Elektronegatiflik
|
|
Bu maddedeki bazı bilgilerin kaynağı belirtilmemiştir. |
Elektronegatiflik, bir atomun kimyasal bağdaki elektronları kendine doğru çekme yeteneğinin bir ölçüsüdür. Doğrudan bir ölçümü yoktur, ancak iyonlaşma enerjisi ve elektron ilgisinin aritmetik ortalaması olarak düşünülebilir.
Soldan sağa doğru iyonlaşma enerjisi ve elektron ilgisi arttığından elektronegatiflik artar. Aşağıdan yukarı ise azalır.
Diğer özellikler
Bir periyotta soldan sağa doğru gidildikçe,
- Proton, nötron sayıları ve kütle numarası artar.
- Atom numarası artar.
- Değerlik elektron sayısı artar.
- Elektron alma isteği (ametalik özellik) artar.
- Yörünge sayısı değişmez.
- Atom hacmi ve çapı azalır.
Bir grupta yukarıdan aşağıya inildikçe,
- Proton, nötron sayıları ve kütle numarası artar.
- Atom numarası artar.
- Değerlik elektron sayısı değişmez (Bu nedenle aynı gruptaki elementlerin kimyasal özellikleri benzerdir).
- Elektron verme isteği (metalik karakter) artar.
- Yörünge sayısı artar.
- Atom hacmi ve çapı artar.
Tarihçe
Altın, gümüş, kalay, bakır, kurşun ve cıva gibi elementler eski çağlardan beri biliniyordu. Bir elementin ilk bilimsel olarak bulunması 1649 yılında Henning Brand'ın fosforu bulmasıyla başlamıştır. Bundan sonraki 200 yıl boyunca elementler ve onların bileşikleri hakkında kimyacılar tarafından pek çok bilgi elde edilmiştir. Bununla beraber 1869 yılına kadar toplam 63 element bulunabilmiştir.
1817 yılında Johann Dobereiner benzer kimyasal özelliklere sahip olan stronsiyum, kalsiyum ve baryuma bakarak, stronsiyumun atom ağırlığının kalsiyum ve baryum atom ağırlıklarının ortasında olduğuna dikkat çekmiştir. 1829 yılında klor, brom ve iyot üçlüsünün de benzer özellikler gösterdiği bulunmuştu. Yine benzer davranış lityum,sodyum ve potasyum için de gözleniyordu. 1829 ve1858 yılları arasında bu konuda pek çok araştırma yapıldı. Bu sıradahalojenler grubu katıldı. Oksijen, kükürt,selenyum ve tellür bir grubun üyesi olarak düşünülürken azot, fosfor, arsenik, antimon ve bizmut başka bir grup içine yerleştirildiler.
İlk periyodik tabloyu oluşturma şerefi Fransız bilim adamı A. E. Beguyer de Chancourtois'e düştü. De Chancourtois, silindirin çevresine 16 kütle birimleri yerleştirerek elementleri buraya oturttu. Benzer özelliklerdeki elementler bu silindir üzerinde düşey satırlarda gruba ayırmıştı. Atom ağırlıkları sekizin katı kadar olan elementlerin özellikleri benzerdi. 1864 yılında yazılan bir yazıda Newlands bunu Oktav kanunu (Law of Octaves) olarak tanımladı. Bu kanuna göre herhangi bir element tablodaki sekizinci elementle benzerlikler gösteriyordu.
Genelde periyodik tablonun babası olarak Alman bilim adamıJulius Lothar Meyer ve Rus bilim adamı Dimitri Mendeleyev kabul edilir. Her ikisi de birbirinden habersiz olarak dikkate değer benzer sonuçlar ürettiler. Mendeleyev atomların artan atom ağırlıklarına göre sıralandıklarında belli özelliklerin tekrarlandığını görmüştür. Daha sonra elementleri tekrarlanan özelliklerine göre alt alta sıralayarak ilk iki periyodu yedişer, sonraki üç periyodu ise onyedişer element içeren bir periyodik sistem hazırlamıştır. Mendeleyev'in hazırladığı periyodik sistemde bazı yerleri henüz keşfedilmemiş elementlerin olduğunu düşünerek boş bırakmıştır. Daha sonra bulunanskandiyum, galyum, germanyum elementleri tablodaki boşluklara yerleşmişlerdir.
1895 yılında Lord Rayleigh, yeni bir soygaz (argon) keşfettiğini bildirdi. Bu element periyodik tabloda bilinen hiçbir yere oturtulamadı. 1898 yılında William Ramsay bu elementin klor ilepotasyum arasında bir yere konulabileceğini önerdi. Helyum da aynı grubun bir üyesi olarak düşünüldü. Bu grup elementlerinin değerliklerinin sıfır olması nedeniyle sıfır grubu olarak adlandırıldı.
Mendeleyev'in periyodik tablosu her ne kadar elementlerin periyodik özelliklerini gösterse de neden özelliklerin tekrarlandığı konusunda herhangi bir bilgi vermemektedir.
Moseley ve modern periyodik yasa
1911'de Ernest Rutherford atom çekirdekleri alfa parçacıklarının saçılması deneyiyle çekirdek yükünün belirlenebileceğini gösterdi. Rutherford'un gösterdiği diğer bir şey bir çekirdeğin yükünün atom ağırlığı ile orantılı olduğuydu. Yine 1911'de A. Van den Broek bir seri çalışmasıyla elementlerin atom ağırlıklarının atom üzerindeki yüke yaklaşık eşit olduğunu gösterdi. Bu yük daha sonra atom numarası olarak tanımlandı ve periyodik tablodaki elementleri yerleştirmede kullanıldı. 1913 de Henry Moseleybir grup elementin X-ışınlar tayf çizgilerin dalga boylarını ölçerek, atom numarası ile elementlerin X-ışınları dalga boylarının ilişkili olduğunu gösterdi. Bu çalışma Mendeleyev, Mayer ve diğerlerinin yaptığı gibi atom ağırlıklarını temel seçmedeki yanlışlığı gösteriyordu.
Fakat neden periyodik özellikler gözleniyor sorusunun yanıtı iseNiels Bohr un elementlerdeki elektronik yapıyı incelemesiyle başlar denilebilir.
Periyodik tablodaki en son büyük değişiklik, 20. yüzyılın ortalarında Glenn Seaborg'un çalışmasıyla ortaya çıktı.1940'da plutonyumu bulmasıyla başlayan araştırması, 94 den 102 ye kadar olan tüm uranyum ötesi elementleri bulmasıyla sürdü. Periyodik tablodaki lantanit serisinin altına aktinitler serisini yerleştirdi. 1951'de Seaborg bu çalışmaları ile kimyada Nobel ödülünü kazandı. 106 nolu element seaborgiyum (Sg) olarak adlandırıldı.
KİMYASAL BAĞLARI TANIYALIM
Kimyasal bağ, atomları birbirine bağlayan ve bir arada kalmalarını sağlayan kuvvetlere, verilen bilimsel ad
Kimyasal bağ örnekleri içeren bir görsel.
Kimyasal bir bağın oluşması ve özellikleri
Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme yapmak gerekirse bağlar oluşurken dışarıya enerji verirler. Atomlar bağ yaparken, elektron dizilişlerini soygazlara benzetmeye çalışırlar.[2] Bir atomun yapabileceği bağ sayısı, sahip olduğu veya az enerji ile sahip olabileceği yarı dolu orbital sayısına eşittir.
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır. Bu üç bağ çeşidi şunlardır[1]:
- İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman meydana gelen bağlara verilen addır. Tepkimeye giren elementlerden birinin atomları, elektron kaybedip pozitif yüklü iyonlara dönüşürken, diğer elementin atomları elektron kazanıp negatif yüklü iyon oluştururlar. Böylece zıt (artı-eksi) bir şekilde yüklenmiş iyonlar arasındaki elektrostatik çekim kuvveti, söz konusu iyonları bir kristal içinde tutar.
- Kovalent bağlar, elektronların bir atomdan diğerine aktarılmaksızın ortaklaşa kullanıldığı bağlara denir. Tek kovalent bağ, iki atom tarafından bölünmüş yani ortaklaşa kullanılan bir elektron çiftinden ibarettir. Moleküller birbirlerine kovalent bağlarla bağlanmış atomlardan meydana gelir.
- Metalik bağlar, metal ve alaşımlarda bulunan bağlardır. Metal atomları üç boyutlu bir yapı içinde düzenlenirler. Bu atomların en dış elektronları, yapının her tarafında serbestçe dolaşır ve atomların birbirlerine bağlanmasını sağlarlar.
İyonik Bağ
Bir metal bir ametalle etkileştiği zaman elektronlar metal atomundan ametal atomuna aktarılır ve bunun sonucunda bir iyonik (veya elektrovalent) bileşik meydana gelir. Atomlardan elektron kaybıyla oluşan pozitif iyonlara ise katyon denir. Atomların elektron kazanarak oluşturdukları negatif iyonlar da anyon olarak isimlendirilir. Bu iyonlar bir araya getirildiklerinde bir kristal oluşturmak üzere birbirlerini çekerler.[3]
A gruplarındaki elementlerin bileşikleri çoğu kez elementlerin simgeleri ile birlikte değerlik elektronlarını gösteren noktalar kullanılarak ifade edilir. Değerlik elektronları baş grup (A grubu) elementlerinin kimyasal tepkimelerinde kullanılan elektronlardır.
Örneğin; bir sodyum atomu ile bir klor atomu arasındaki tepkimeyi ele alalım:
Sodyum 1A grubunda olup sadece bir değerlik elektronuna sahiptir. Klor atomu ise 7A grubunun bir üyesi olduğundan 7 değerlik elektronuna sahiptir. Bu iki atom arasındaki tepkimede sodyum atomu 1 elektron kaybeder. Sodyum atomunun kaybetmiş olduğu elektron klor atomu tarafından kazanılır.
Sodyum çekirdeği 11 proton (11+ yük) ve sodyum iyonu da yalnız 10 elektron (bir elektron kaybetmiş oluyor) içerdiğinden sodyum atomunun bir elektron kaybetmesiyle 1+ yüklü sodyum iyonu oluşur. Diğer taraftan, klor çekirdeği 17 proton (17+ yük) ve klor iyonu da 18 elektron (bir elektron kazanılmış oluyor) içerdiğinden klor atomunun bir elektron kazanmasıyla da 1- yüklü bir klorür iyonu meydana gelir.
Sonuç: Görüldüğü gibi, bu tepkimede, sodyum tarafından kaybedilen elektronların toplam sayısı klor tarafından kazanılan elektronların toplam sayısına eşit olmalıdır. Böylece oluşan sodyum iyonlarının sayısı ile meydana gelen klorür iyonlarının sayısı aynı olduğundan NaCl formülü bileşikte bulunan iyonların en basit oranını (1:1) verir. Bu iyonlar bir kristal oluşturmak üzere birbirini çekerler.
Sodyum klorür kristalinde bir iyonun tümüyle diğer bir iyona ait olduğu söylenemez. Aksine, kristal yapıda her bir sodyum iyonu altı klorür iyonu ile her bir klorür iyonu da altı sodyum iyonu ile çevrilmiştir. Kristal içerisinde iyonların bu şekilde düzenlenmesiyle benzer yüklü iyonların birbirlerini itmeleri, zıt yüklü iyonların birbirlerini çekmeleri tarafından bastırıldığı için net çekim kristalibir arada tutar.
Kovalent bağ
Elektronları bağlamak için girilen yarışma, iyon bağında olduğu kadar şiddetli değilse atomların var olan dış elektronlar paylaşılır ve bir ortaklaşma bağı ya da kovalent bağ oluşur.[4]
Ametal atomları etkileştiği zaman kovalent bağlarda bir arada tutulan moleküller oluşur. Bu atomlar elektron çekimi bakımından birbirlerine benzediklerinden, kovalent bağların oluşması sırasında herhangi bir elektron aktarımı olmaz. Bunun yerine elektronlar ortaklaşa kullanılırlar. Kovalent bir bağ genellikle iki atom tarafından parçalanmış ters spinli bir elektron çifti içerir. Kovalent bağlar yapısına göre ikiye ayrılır[4]:
Apolar kovalent bağ: Aynı cins iki ametal atomunun birleşmesiyle oluşur. Apolar kovalent bağa en iyi örneklerden biri, iki oksijen atomunun elektronlarını ortaklaşa kullanarak oluşturdukları bağıdır. Bu bağlarda ortaklaşa kullanılan elektronlar eşit paylaşıldığından dolayı molekülün pozitif veya negatif kutbuyoktur.[4]
Polar kovalent bağlar: İki farklı cins atomun bir araya gelmesiyle oluşur. Bu bağlarda ametallerden biri ortaklaşa kullanıldığından dolayı molekülün bir ucu pozitif (+), diğer ucu negatif (-) yüklenir. Suyu oluşturan hidrojen ve oksijen moleküllerinin son orbitallerindeki elektronların ortak kullanılmasıyla polar kovalent bağ oluşur.[4]
Örnek olarak, iki hidrojen atomundan oluşan bir bağ düşünülebilir. Her bir hidrojen atomu 1s orbitalinde atom çekirdeği etrafında simetrik bir dağılım gösteren tek bir elektrona sahiptir. İki hidrojen atomu bir kovalent bağ oluşturduğu zaman atomik orbitaller öyle bir şekilde üst üste binerler, böylece çekirdekler arasındaki bölgede elektron bulutları birbirlerini destekleyip bu bölgedeki elektronun bulunma olasılığını arttırırlar. Pauli dışlama ilkesine göre bağı oluşturan iki elektron mutlaka ters spinli olmalıdır.[5] Bir kovalent bağın kuvveti, pozitif yüklü çekirdek ile bağa ilişkin negatif elektron bulutu arasındaki çekimden gelir.
Metalik bağlar
Metallerin iyonlaşma enerjileri ile elektro-negatiflikleri oldukça düşüktür. Bunun sonucu olarak metal atomlarının en dış elektronları nispeten gevşek tutulur. Metalik bir kristalde, en dış elektronları çıkarılmış atomlardan ibaret olan pozitif iyonlar kristal örgüde ilgili yerlerde bulunur ve en dış elektronların örgünün her tarafında serbestçe hareket etmesiyle de kristaldeki atomlar bir arada tutulur. Diğer bir deyişle örgü içersinde dağılan ve kristalin bütününe ait olan elektron bulutu ile pozitif iyonlar arasındaki elektrostatik çekim metalik bağı oluşturmaktadır.
Bant kuramı
Bant kuramı metalik bağlanma şeklini, tüm kristalin her tarafını kapsayan moleküler orbitaller cinsinden açıklayan kuram.[6]
Metalik katıların çoğu hareketlidir. Bunun sonucu olan artı iyonlar, genişlemiş bir üç boyutlu diziliş içinde yer alırlar; ama elektronlar yöresizleşir. Bu maddelerin yüksek [ısı]], iletkenliği, dayanıklılık, yüksek kaynama noktası, yüksek yoğunluk, renk ve elektrik iletkenliği gibi özelliklerinin birçoğu, hareketli elktronlardan kaynaklanır. Yalnızca birkaç iyon yığışması şeması uygulanabilir ve X ışını çözümlemesi, metal iyonlarının genişlemiş örgülü yapı içinde kazandığı bağ uzunlukları ve geometrik şekiller konusunda ayrıntılı bilgi sağlar. Basit küp biçimi şekiller, ortada başka bir iyonun bulunduğu küp biçimi şekiller ve altıgen yığışma, en sık rastlanan şekillerdir. Metal alaşımları, erimiş haldeki metallerin karıştırıldıktan sonra dikkatlice soğutulmasıyla elde edilir. Bu yolla oluşan gereçlerin özellikleri bileşenlerinin özelliklerinden genellikle çok farklıdır.
ASİTLER-BAZLAR
ASİTLER
Asitler, suyla hidrojen iyonları üreten hidrojen bileşimleridir. Hidrojen iyonları çözeltiyi asidik yapar. Asitler mavi turnusol kağıdına kırmızı renk verir. Eski Türkçede hamız, ve bazı kaynaklarda da ekşit denir.
Gıdaların çoğu asit içerir. Limonda sitrik asit, sirkede ise asetik asit bulunur. Farklı asitler, limona, sirkeye, ekşi elmaya ve şerbete keskin tadını verir. Aküler, sülfürik asit; midedeki sindirim sıvıları, hidroklorik asit içerir. Asitler, suda eridiğinde hidrojen iyonları (H+) üreten madde çözeltileridir. Asit maddelerin çoğu, saf katılar, sıvılar ya da gazlar olarak bulunsa da, sadece suda eridiğinde asit gibi tepki verir.
Asitlerin özellikleri
Asitler, çözeltiye hidrojen iyonu bırakan bileşiklerdir. Bütün asitler hidrojen (H+) içerir. Genelde;
1- Tatları ekşidir 2- Mavi turnusol kağıdını kırmızıya çevirirler 3- Bazlarla tepkimeye girdiklerinde tuz ve su oluştururlar. Bundan başka çok çeşitlilik gösteren başka özellikleri de bulunur. Bu spesifik özellikler, anyon muhtevası ve ayrılmamış moleküllerden dolayı olur. Çeşitli asitlerin molekülleri, çözeltiye farklı miktarda serbest Hidrojen bırakma eğilimindedirler.


Asit türleri
Asitler başlıca iki grupta toplanabilirler:
İnorganik asitler
Minerallerden ve metal olmayan maddelerden yapılan asitlere, inorganik asitler adı verilir. Yaygın inorganik asitler arasında, sülfürik asit (H2SO4), hidroklorik asit (HCl), nitrik asit(HNO3) vefosforik asit (H3PO4) yer alır. Endüstri her yıl bu asitlerden milyonlarca üretir. Bunlar plastik, lif, gübre, boya kimyasallarının yapımında kullanılır. Konsantre inorganik asitler çok aşındırıcıdır. Cilde zarar verebilir ve diğer metallerin içinde hızla eriyebilirler. Hidroflorik asit (HF), camın yapısını bozarken diğer inorganik asitler cam için tehlikeli değildir.
Organik asitler
Bitkiler, hayvanlar ve insanlar, organik asitler adı verilen çeşitli asidik karbon bileşimleri üretir. Bunların çoğu zararsızdır; meyveler ve diğer yiyeceklere tat verir.
Organik asitler yapıları karbon iskeletine dayalı asitlerdir. Formik, asetik, propiyonik, bütirik, fumarik, sorbik, sitrik ve malik asit gibi asitler ve bunların tuzları başlıca organik asitlerdir.
Doğada saf olarak bitkisel ve hayvansal organizmada bulunabilirler ve ayrıca doğal yollardan elde edilebilirler. Hayvan vücudunda kullanılıp, metobolize olduktan sonra karbondioksit ve suya okside olurlar.
Dolayısıyla canlı organizma için herhangi bir sağlık sorunu ya da bir risk oluşturabilecek hiçbir kalıntı bırakmazlar.
Bu özellikleri nedeniyle organik asitler,kâr büyütme faktörlerinin hayvan beslemede kullanımının yasaklanmasından sonra antibiyotiklerin yerini alabilecek çok sayıda yapay organik asit üretilmiştir.
Bazı asitler ve bulundukları yerler
- Akrilik asit : bazı boyalarda bulunur.
- Asetik asit : sirkelerde bulunur.
- Asetilsalisilik asit : Aspirin®'de bulunur.
- Askorbik asit : C vitamini : turunçgillerde bulunur.
- Benzoik asit : hazır meyve sularında bulunur.
- Bütirik asit : tereyağında bulunur.
- Folik asit : çilekte bulunur.
- Formik asit : karıncada bulunur.
- Fosforik asit : bazı ilaçlarda bulunur.
- Karbonik asit: gazozda bulunur.
- Laktik asit : sütte veya yoğurtta bulunur.
- Malik asit : elmada bulunur.
- Nitrik asit : kezzapta bulunur.
- Oleik asit : zeytinyağında bulunur.
- Sitrik asit : limonda bulunur.
- Tartarik asit: üzümde bulunur.
BAZLAR
Baz, suda iyonlaştıklarında ortama OH- (hidroksit) iyonu ve elektron çifti verebilen maddelere verilen isim.
Genel özellikleri
- Suda iyonlaşabilirler
- Sudaki çözeltileri elektriği iletir
- Tatları acıdır
- Ele kayganlık hissi verir
- Turnusol kağıdını kırmızı renkten mavi renge çevirirler
- Amfoter metallerle H2 gazı açığa çıkarırlar




SU KİMYASI VE SUYUN SERTLİĞİ
DOĞAL ÇEVRE
Var olan doğal denge bütün canlılar için çok önemlidir.Çevreyi oluşturan canlı halkalardan birinin yok olması,diğer canlıların olumsuz etkilenmesine neden olur.(Besin zinciri)
Veya ormanların yok olmasının çevreye olumsuz etkileri olduğunu söyleyebiliriz..Ormanların yok olması ormanda yaşayan canlı türlerinin de yok olmasına neden olur.Hava kirliliği artar.Yağışlar ve erozyon artar.Asit yağmurları da canlı ve cansız varlıklara zarar verir.
ASİT YAĞMURLARI
(CO2) gibi gazlar havadaki su buharı(H2O) ile birleştiklerinde asit oluştururlar. Bu asitler yağmurla birlikte yeryüzüne düşer.Bu şekilde oluşan yağışlara asit yağmuru denir.
insanlar yaşamlarını sürdürürken beslenirken, ısınırken, enerji üretirken ve daha birçok faaliyeti yaparken ortaya birtakım maddeler çıkar. Bunlardan bitkisel ve hayvansal maddeler gözle görülmeyen canlılar tarafından parçalanarak toprağa karışır, çevreye zarar vermez.
Pet şişe, naylon torba, pil v.b maddeler ile ısınmak ya da enerji elde etmek için yakılan kömürlerden çıkan dumanlar çevreyi kirletir. Nüfusun artması, atık maddelerin de artması anlamına gelir ve çevre kirliliğine neden olur.
Kullanıldıktan sonra atılan ve çevre kirliliğine neden olan zararli maddelere atık denir. Atıklar insanlara, hayvanlara ve bitkilere zarar verir.
Toprağın Önemi
Yeryüzünün en üst tabakasını oluşturan örtüye toprak denir.Toprak tüm canlıların besin ve hayat kaynağıdır.Bitkiler;insan ve hayvanların, toprak ise bitkilerin besin kaynağıdır. Çünkü bitkiler ihtiyaç duyduğu inorganik besin ve suyu topraktan alırlar. Toprağın canlılara sağladığı faydalardan biri de yer altı sularının süzülerek canlıların kullanabileceği hale getirilmesidir.(doğal arıtma)
Toprak Kirliliğinin Nedenleri
Toprak kirliliğine neden olan başlıca etmenler ev, iş yeri ve hastahane atıkları.
Radyoaktif atıklar.
Hava kirliliği sonucu oluşan asit yağmurları,
Gereksiz yere ve aşırı miktarda yapay gübre, tarım ilacı vb. kullanılması.
Tarımda gereksiz yere ya da aşırı hormon kullanımı
Suların kirlenmesi. Su kirliliği toprak kirliliğine neden olurken, toprak kirliliği de özellikle yer altı sularının kirlenmesine neden olur.
Neler Yapılabilir?
Verimli tarım topraklarında yerleşim ve sanayi alanları kurulmamalı yeşil alanlar arttırılmalıdır.
Ev ve sanayi atıkları toprağa zarar vermeyecek şekilde toplanıp depolanmalı ve toplanmalıdır. Yapay gübre ve tarım ilaçlarının kullanılmasında yanlış uygulamalar önlenmelidir.
Nükleer enerji kullanımı bilinçli şekilde yapılmalıdır.
Hava Kirliliğinin Nedenleri
Fabrikalardan ve evlerden çıkan pis ve zehirli atıkların deniz, göl ve akarsulara karışması su kirliliğine neden olur.
Su Kirliliğinin Nedenleri
Neler Yapılabilir?
Pis ve zehirli sular antma tesislerinde temizlenmelidir. Fabrikalar sıvı atıklarını süzgeçlerden geçirerek dışarı boşaltmalıdır.
Sert sular kireç oluşturur.(Çaydanlıkların dibinde birikir.)
Sert sularda deterjan ve sabun gerektiği gibi köpürmediği için bu sular temizlik yapmaya uygun değildir.Daha fazla deterjan ya da sabun kullanılması gerekir.
Sağlıklı bir içme suyunda olması gereken birtakım özellikler :

ÜNİTE 4 SES
Ses, atmosferde canlıların işitme organları tarafından algılanabilen periyodik basınç değişimleridir. Fiziksel boyutta ses, hava katı sıvı veya gaz ortamlarda oluşan basit bir mekanik düzensizliktir. Bir maddedeki moleküllerin titreşmesi sonucunda oluşur.
Yayılma
Sesin yayılması için maddesel ortama ihtiyaç vardır. Yani boşlukta ses yayılmaz. Ses dalgalar halinde yayılır. Ses kaynağından çıkan ses maddenin taneciklerini titreştirir. Bu nedenle ses yayılır. Ses dalgasının her bir tam devrinde bir sıkışma ve bir seyrekleşme serisi vardır. Ses, tanecikler halinde yayılır, tanecikler ne kadar sık ise o kadar hızlıdır. Sesin yayılma hızı sırasıyla katıdan sıvıya, sıvıdan gaza azalır. Hız (V) = uzaklık (D)/ süre (T) biçiminde gösterilen genel hız formülü aslında teorik bir değer niteliği taşımamaktadır. Çünkü bu formülde göz önüne alınmayan dış faktörler, ses dalgalarının hızı üzerinde bir dizi etkiler yaratır. Örneğin rüzgar sesi uzaklara taşır, gece ve gündüzün sıcaklık farkları ses dalgalarını etkiler. Ses dalgaları katılarda yaklaşık olarak 5000 m/s hızla yayılır. Suda 1453 m/s hızla yol alır. Havada 340 m/s yol alır. Ses kaynakları ikiye ayrılır bunlar doğal ses kaynakları ve yapay ses kaynaklarıdır.
Ses kaynakları
Ses veren her madde bir ses kaynağıdır. Sesler kaynaktan aldığı enerjilerle titreşerek yayılırlar. Titreşen cisimler esnek olup sesi oluşturur. Esnek olan cisimler ses dalgaları meydana getirebilir ve ses dalgalarını iletebilir. Ses mekanik dalga olduğu için yayılması için bir ortama ihtiyaç duymaktadır. Ses dalgaları ortamlarda sıkışma ve genleşme şeklinde boyuna ilerleyen dalgalardır. Ses dalgalarının basıncı olup girişim sunucu vuru oluştururlar.
Doğal ses kaynakları
Yağmur,rüzgâr,akarsular,gök gürültüsü,canlı sesleri ve doğa sesleri gibi kendiliğinden ses çıkaran ses kaynaklarıdır.
Yapay ses kaynakları
Makine,telefon ve enstrüman gibi üretilmiş araç veya gereçler yapay ses kaynaklarıdır.
Frekans
Sesin bir frekansı, boyu, periyodu ve hızı bulunmaktadır. Sesin birim zamandaki (genellikle saniye) titreşim sayısına "frekans" denir. Birimi ise Hertz (Hz)dir. Dalga boyu, bir ses dalgasının oluşması için sesin aldığı yoldur. Sesin hızı normal koşullarda; havada 340, tahtada 4000-6000, suda 3000-5000, çelikte ise 8000 m/s dir. Ses boşlukta yayılmaz. Çünkü titreşen bir cismin sıkışıp genleşmesine yol açabilecek atom ya da molekül gibi tanecikler yoktur.
Çok alçak frekanslı ses (Infrasonic)
Sesberi ya da infrasound olarak nitelendirilen ses frekansları, 20 Hz den az olurlar. Böylece insan kulağının duyamayacağı kadar düşük, fakat hava basıncı değişiklikleriyle oluşan ses dalga frekanslarından daha yüksektirler.
İnsan kulağının teorik olarak 20 Hz ile 20000 Hz arasını duyduğu söylense de, en iyi 250 Hz ve 3000 Hz arasındaki konuşma frekansı bölgesini duyar. Hayvanlar, insanların duyamadığı ses frekanslarını bile algılayabilirler. Örneğin fillerin ayağında çok alçak frekansları algılayan doğal alıcılar vardır.
Çok yüksek frekanslı Ses (Ultrasonic/ultrasonik)
Sesöte ya da ultra sound, insan kulağının duyamayacağı çok yüksek frekanstaki seslere verilen addır. Frekansı 20.000 Hz'in üstündedir.
Hayvanlar 20.000 Hz den yukarisini duyabilirler. Francis Galton (1822-1911) köpeklerin bu özelliğinden yararlanarak Galton Köpek Düdüğünü tasarlamıştır. Sadece köpeklerin duyabileceği frekanslardaki sesleri veren bu düdük köpek terbiyeciliğinde ve istenmeyen köpeklerin uzak tutulmasında kullanılmaktadır. Frekansı 16000 ile 22000 Hz arasındadır. Uygulamada bu kadar yüksek sıklığa sahip ses, insan kulağı tarafından duyulamamaktadır.
ISI
Isı, belirli sıcaklıktaki bir sistemin sınırlarından, daha düşük sıcaklıktaki bir sisteme, sıcaklık farkı nedeniyle transfer edilen enerjidir. Isı da iş gibi bir enerji transfer biçimidir. Isı sistem sınırlarında ve geçiş hâlinde iken belirlenebilir. Her ikisi de birer eğri fonksiyonudurlar. Bir başka deyişle, ısı ve iş geçiş hâlindeki enerjilerdir. Isı sıcak bir maddenin soğuk maddeye ilettiği sıcaklığı sağlayan bir enerji türüdür.Isı kalorimetre ile ölçülür.
Isı birimi olarak iş biriminde olduğu gibi joule (j) kullanılır. Eskiden kullanılan kalori (cal) ısı denklemlerinde artık kullanılmamaktadır.

Isı ve sıcaklık arasındaki farklar
Sıcaklık, bir cismin sıcaklığının ya da soğukluğunun bir ölçüsüdür. Bir sistemin ortalama moleküler kinetik enerjisinin bir ölçüsüdür. Gazlar için kinetik enerji, mutlak sıcaklık dereceleriyle orantılıdır. Bir başka deyişle, ısı geçiş hâlindeki enerjidir. Isı sıcak bir maddenin soğuk maddeye ilettiği sıcaklığı sağlayan bir enerji türüdür.
Yani ısı bir enerji, sıcaklık ise bir ölçüdür. Aşağıdaki formülde bu daha iyi görülmektedir:
- Q: verilen veya alınan ısı enerjisi miktarı
- m: kütle
- c: öz ısı
- ΔT: sıcaklık farkı (sıcaklık değişimi)
- Q=m.c.ΔT
Sıcaklık, bir cismin sıcaklığının ya da soğukluğunun bir ölçüsüdür. Bir sistemin ortalama moleküler kinetik enerjisinin bir ölçüsüdür. Gazlariçin kinetik enerji, mutlak sıcaklık dereceleriyle orantılıdır.
- Duyularla algılanmakta ve genellikle sıcak veya soğuk terimleri ile ifade edilmektedir. Teknik olarak bu değerlendirme doğru değildir. İki cisim birbirisine temas ettirildiğinde sıcak olan soğumakta soğuk olan ısınmakta ve belirli bir süre temas halinde kaldıklarında her ikisi de aynı sıcaklığa gelmektedir. Buradan yola çıkarak sıcaklık bir maddenin ısıl durumunu belirten ve ısı geçişine neden olan etken olarak tanımlanabilir.
- Termik denge halinde bulunmayan sistemle çevresini termik denge haline getirmeye zorlayan potansiyeldir. Termik denge sağlandıktan sonra bu potansiyel kalkmakta sistemde çevresiyle aynı değeri almaktadır.
- Noktasal bir özelliktir.
- Bir maddenin ortalama hıza sahip herhangi bir molekülünün kinetik enerjisiyle doğru orantılı olan büyüklüğüne denir.
- Sıcaklık genleşmeye bakılarak dolaylı yoldan ölçülebilir. Ölçümünde termometre denilen cihaz kullanılmaktadır.
- Bir cismin etrafına kendiliğinden enerji verme eğiliminin bir ölçüsüdür. Enerji veren madde daha yüksek sıcaklıktadır.

Sıcaklık birimleri
- Celsius (°C)
- Fahrenheit (°F)
- Kelvin (°K)
- Planck (TP)
- Rømer (°Rø)
- Réaumur (°R)
- Newton (°N)
- Delisle (°De)
Günlük hayatta sıcaklık birimi olarak en çok derece Celcius (°C) kullanılmaktadır. Bilimsel işlemlerde ise daha çok Kelvin ölçeği kullanılır.
ÜNİTE 6 CANLILAR VE ENERJİ İLİŞKİLERİ
CANLILARDA BESLENME
Beslenme, canlılığın gereklerini yerine getirmek için gerekli olan maddeleri, canlı dışı ortamdan edinme faaliyetine verilen isimdir. Canlılar beslenme şekillerine göre 2'ye ayrılırlar:
- Ototrof canlılar (kendibeslek)
- Heterotrof canlılar (ardıbeslek, dışbeslek)
Bu ayrımda temel kriter, canlının yaşamını sürdürmek, diğer deyişle metabolizma faaliyetlerini sürdürebilmek için gereken enerjinin kaynağıdır. Ototrof canlılar bu enerjiyi doğal çevreden alırlar, heterotrof canlılar ise, başka canlıların biyokütlelerinde depolanmış enerjiyi kullanırlar.
Metabolizma için gereken enerji, organizma açısından besindir. Dolayısıyla ototrof organizmalara, kendi besinini üretebilen organizmalar demek de olanaklıdır. Keza, heterotrof organizmalar da başka canlıları "yiyerek" beslenen organizmalardır.
Canlıların beslenme biçimleri yönünden ototrof ve heterotrof olarak ayrımı, bu canlıların kullandıkları karbonun kaynağı açısından da net bir ayrımdır. Ototrof organizmalar, metabolizma için gereken karbonu atmosferdeki karbondioksitden alırlar. Heterotrof organizmalar ise gerekli karbonu, diğer canlıların biyokütlelerinden sağlarlar. Dolayısıyla ekosistemde yer alan canlılar, ekosistemdeki karbon çevrimi içinde farklı rollere sahiptirler.
1. Ototrof Canlılar
Kendi besinlerini kendi sentezleyen, su (H2O), karbondioksit (CO2) ve inorganik tuzlardan organik maddeyi oluşturan, enerjiyi bu organik bileşiklerde depolayan canlılardır. Kendi içinde iki gruba ayrılırlar:
- Fotosentetik ototroflar (Fototroflar); biyokimyasal olaylar için gereksinim duydukları enerjiyi güneş ışınlarından, fotosentezle sağlayan canlılardır. Örn: Yeşil ve mor bakteriler.
- Kemosentetik ototroflar (Kemotroflar), kendileri için gerekli olan enerjiyi amonyak (NH3), hidrojensülfür (H2S) gibi belli organik maddeleri oksitleyerek, kimyasal yoldan, kemosentezle sağlayan canlılardır. Örneğin nitrit, nitrat ve demir bakterileri böyledir.
Ototrof canlılar, inorganik bileşikleri kullanarak organik bileşikler dediğimiz karmaşık ve uzun molekül zincirlerini üretebilen canlılardır. Diğer bir anlatımla bu canlılar, yaşamsal etkinliklerini sürdürebilmek için gereksinim duydukları tüm organik bileşikleri, doğrudan doğruya inorganik bileşikleri sentezleyerek elde ederler. Bu canlılar, karbondioksidi indirgiyerek organik bileşikler sentezlerken, işlemin kimsayal karakteri dolayısıyla enerjiye gereksinim duyarlar. Bu enerji, ışık -büyük ölçüde güneş ışığı- ya da kimyasal enerjidir.
Besin maddeleri olarak da adlandırılan, enerji depolanmış organik bileşiklerin sentezlenmesinde güneş ışığını kullanan canlılara fotosentetik canlılar ya da Fototroflar, kimyasal enerjiyi kullanan canlılara da kemosentetik canlılar ya da Kemotroflar adı verilir.
2. Heterotrof Canlılar
Ototrof organizmaları ve çürüyen maddeleri besin olarak kullanan canlılardır. Hayvan ve mantarların tümü ile birçok bakteri türü bu gruba girmektedir. Heterotrof organizmalar beslenme özellikleri yönünden 3 grupta incelenebilir:
2. 1. Holozoik formlar; besinlerini katı parçacıklar halinde alarak sindiren canlılardır.
Örneğin hayvanların birçoğu böyledir
Aldıkları besinin yapısına göre üçe ayrılır:
a- Herbivor (sadece bitkilerle beslenenler)
b- Karnivor (sadece etle beslenenler)
c- Omnivor (hem ot, hem etle beslenenler)
2. 2. Saprofitik formlar; organik maddeleri doğrudan hücre zarlarıyla absorbe eden canlılar.
Örn: Mayalar, küfler, bakterilerin birçoğu.
Bu canlılar hücre zarı dışına salgılayabildiklari sindirim enzimleriyle hücre dışında sindirim yaparlar. Daha sonra da bu enzimlerle parçalanan bileşikleri hücre zarlarıyla metabolizmalarına alırlar. Hücre dışında gerçekleşen bu tepkimeler, organik bileşikleri yeniden inorganik bileşiklere ayrıştırmaktadır. Saprofitler, ekosistemdeki madde çevrimi yönünden önemli bir işlev görürler.
2. 3. Parazitik formlar; bitkisel ya da hayvansal parazitler konukçu olarak tanımlanan bir bitki ya da hayvan üzerinde ya da içinde yaşar ve besinini konukçudan sağlayan canlılardır. 2 çeşittir:
a- Endoparazitler: Vücut içinde yaşarlar. Örn: Bağırsak solucanı.
b- Ektoparazitler: Vücut dışında yaşarlar. Örn: Bit, pire, vb.
Bazı tür canlılar hem ototrof hem de heterotrof beslenme biçimlerini kullanılar. Bu tür canlılara örnek Böcekçil bitkilerdir. Bu tür bitkiler esasen fototrofturlar. Ancak böceklerin biyokütlelerini sindirerek de madde alışı yapmaktadırlar. Böcekleri sindirmeleri, bitkinin azot gereksinimini sağlamak içindir.

MADDE DÖNGÜLERİ
MADDE DÖNGÜSÜ NEDİR?
Ekosistem birbirleri ile ilişkili olan canlı ve cansız varlıklardan oluşmuştur. Ekosistem bu varlıklar arasındaki madde ve enerji alışverişi ve dolaşımı sayesinde kendisini yeniler ve besler. Ekosistemin enerjisini güneş sağlar, ancak hayatın devamı için gerekli olan su ve diğer kimyasal maddeler dünyamızda yer alır.Ekosistemlerde madde varlığı sınırlıdır, alınan maddeler yerine konmadığı takdirde tükenmeye mahkûmdur.Ekosistemlerin dengesini koruyabilmesi ve varlığını sürdürebilmesi (dünyada hayatın devamı için) madde ve enerji döngüleri sırasında alınan maddelerin yani inorganik maddelerin kullanıldıktan sonra cansız ortama geri verilmesi sayesinde olabilir.
Doğada yaşamın sürekliliği için karbon, su, oksijen, azot, oksijen ve fosfor gibi maddeler ekosistem içinde devirli olarak kullanılırlar. Yani canlılar ihtiyaç duydukları bu maddeleri yaşadıkları ortamdan alır, kullanır ve bir şekilde ortama geri verirler ve sürekli olarak devirler yapıp yenilenerek canlılar tarafından tekrar kullanılır. Birinci Termodinamik Kanunu gereğince hiçbir madde ortamdan kaybolmaz, ancak çeşitli kimyasal değişimler geçirebilir.
Hayatın devamı için gerekli olan maddelerin ekosistem içinde canlılar ve cansız çevreleri arasındaki dolaşımına Ekolojik Madde Döngüleri ya da Madde Çevrimleri denir. Bu döngülerin biyolojik, kimyasal ve jeolojik etmenleri olduğundan Biyojeokimyasal Döngüler de denir. Madde döngüsünün enerji akışından farkı ekosistem içinde sürekli devir yapmasıdır. Madde döngüleri güneş enerjisi sayesinde gerçekleşir.
SU DÖNGÜSÜ
Su, bazı doğal kuvvetler ve hava hareketleriyle atmosfer ile yer yüzündeki karalar ve sular arasında sistemli bir şekilde hareket etmektedir.Buna su döngüsü veya hidrolojik dolaşım denir.Güneş enerjisinin ısıtmasıyla ,çeşitli kaynaklardan atmosfere çıkan su buharı;yağmur,kar, dolu gibi yağış biçimleriyle yeniden yer yüzüne döner.Bu suyun bir miktarı yer altı sularına karışırken,daha büyük bir kısmı,göl ve deniz gibi kaynaklarda birikir.

ga.water.usgs.gov/.../turkish/wcdiagram.jpg
Su döngüsü de,öteki tüm döngüler gibi süreklidir.Bitkiler de terleme ile su döngüsüne katılır.Yer yüzündeki bütün sular,su döngüsüne katılmaktadır.Yani,denizlerden buharlaşan su,yağış olarak yer yüzüne dönmekte, bir kısmı yüzeysel sularda birikip ,bir kısmı da yer altı sularına karışmaktadır. Yer altı sularının son toplanma yeri ise deniz ve okyanuslardır.Burada toplanan sular,su döngüsüne devam eder (uzun su devri).Deniz ve okyanuslardan buharlaşan suyun karalara geçmeden tekrar yağmur, kar,dolu, biçiminde deniz ve okyanuslara geçmesine kısa su devri denir.Buharlaşma ve terleme yoluyla yükselen su,bulutlarda yoğunlaşır.Bunun sonunda da yağış oluşur.Yağış olarak geri dönen suyun bir kısmı yüzey sularında (göl ve denizlerde) depo edilir.
Diğer kısmı yer altı sularına karışır.Toprağa giren su , yer altı suyu olarak tekrar denizlere akar. Bu şekilde su döngüsü tamamlanmış olur.
Su döngüsü 3 evre halinde gerçekleşir.
www.dask.org.tr/.../moisture/water-cycle-tr.gif
1.Buharlaşma: Suyun ısınarak buharlaşması, bitkilerinde terleme yoluyla atmosfere verilmesidir. Yeryüzündeki buharlaşma güneşin sıcaklık etkisi ile gerçekleşir. Suyun buharlaşma alanları denizler, okyanuslar, akarsular, yağış alanları ve toprak yüzeyidir. Ayrıca bitki ve diğer canlıların terlemesi de buharlaşma alanları arasında yer alır. Buharlaşma yoluyla su atmosfere verilir.
2.Yoğunlaşma: Su buharının soğuyarak doygun hale gelince su zerreciklerine ve buz kristallerine dönerek bulutları oluşturmasıdır.
3.Yağışlar: Yoğunlaşan su zerreciklerinin daha soğuyup su damlaları halinde yer çekimi etkisiyle yere düşmesidir. Yeryüzüne düşen suların bir kısmı toprak derinliklerindeki bitki köklerine alınır, bir kısmı da diğer canlılar tarafından kullanılır. Yağışlarla yeryüzüne düşen suyun büyük bir kısmı yüzey akıntıları şeklinde deniz, okyanus, akarsu ve göllere karışarak akarsular, göller ve yeraltı suları yoluyla denizlere ulaşarak döngüyü tamamlar.
Yağışlar su döngüsünün önemli bir parçası olup suyun tekrar tekrar kullanılmasını sağlar. Bir yağmur damlası bir yıl içinde tekrar tekrar buharlaşıp yeniden yağarak yeryüzüne döner. Böylece 4 milyon km³ su karalar atmosfer arasında hareket eder.
Toprak tabakasının çeşidi, arazinin eğimi, bitki örtüsü, yeraltı ve yer üstü sularının şekil ve durumları su döngüsünü etkiler. Doğal bitki örtüsü sel tahribatını önler, yağışların dengeli dağılımını sağlar. Doğal bitki örtüsünün azalması ile birlikte yağış miktarı azalır, yağış miktarı azalınca canlıların yaşam kaynağı olan mineral döngüleri de bozulur.
Ancak insanlar tarafından kullanılan sular kimyasal maddeler, fabrika atıkları, nükleer atıklar, tarım ilaçları, yapay gübreler vb. kirletilen bu sular yağışlarla yeraltı suyu ve içme sularına karışır. Doğal döngü içinde de yeterince temizlenemez ve canlılar için büyük bir tehlike oluşturmaktadır.
KARBON DÖNGÜSÜ
Karbon atomlarının fiziksel, jeolojik, kimyasal ve diğer süreçler sonucunda atmosfer, okyanuslar, yeryüzü vb. arasındaki dolaşımı. Karbon atomları canlı dokularını meydana getirdikleri için tüm yaşamın temel taşıdır. Karbonun çoğu karbondioksit şeklinde bulunur. YERYÜZÜNDE KARBONUN DÖRT ANA KAYNAĞI
1.Atmosfer (havaküre):Karbondioksit
2.Hidrosfer (Suküre):Karbondioksit ve bikarbonat
3.Litosfer (Taşküre):Petrol,kömür,doğal gaz,karbon
4.Biyosfer (Canlılar Küresi):Canlı bünyesindeki organik moleküller
Doğadaki karbonun çoğu karbondioksit şeklindedir. Karbondioksitten çıkan karbon fotosentez için çok önemlidir. Havadaki karbon dioksit, su ve besleyici tuzlarla birlikte fotosentez işleminde kullanılır.
Bu işlem sonucu oksijen ve organik maddeler üretilir.Yeşil bitkiler, havadan karbondioksiti alarak fotosentez sonucunda organik bileşiklere dönüştürürler. Bitkilerin yapısındaki bu karbon bitkilerle beslenen hayvanlara ve besin zinciri yoluyla diğer canlılara geçer. Bu canlıların atıklarıyla ve fosilleriyle toprağa karışır ve bakteriler tarafından parçalanarak toprağın yapısına katılır.
www.ilimsel.com/index.php?option=com_content...
Solunumda ise bunun tersi olur. Yani organik maddeler oksijen eşliğinde parçalanır. Bu işlemde karbon dioksit ve su üretilir. Oksijensiz ortamda yaşayan bazı mikroorganizmalar mayalanma (fermantasyon) yoluyla glikozu alkol ve karbondioksite dönüştürürler. Bu yolla elde ettikleri enerjiyi metabolik işlemlerde kullanırlar.Organik maddelerin parçalanması sonucu serbest kalan karbon dioksit çevirime yeniden girer. Böylece karbon döngüsü tamamlanmış olur.
Karbondioksit sıcaklığı tutucu etkisi olan bir gazdır. ( sera gazı) Günlük ve mevsimlik sıcaklıkların aşırı artmasını ve azalmasını engeller. Aşırı artması yere gelen sıcaklığı tutarak küresel ısınmaya neden olmaktadır.
Denizlerle atmosfer arasında karbon alışverişi çok yavaştır. Bu da ilk 100 metrede olur. Karalardan erozyon ile taşınan inorganik ve organik maddeler aracılığı ile karbon denize gelir. Karadan gelen, kabuklu hayvanların bünyesindeki organik karbon, karbonat, bikarbonatlar deniz tabanlarında tortullar içinde birikir. Denizler karalara göre 50 kat daha fazla karbon içerdikleri için karbon akışını düzenleyen en önemli kaynaklardır.

www.harunyahya.org/.../mikrodunya1.html
Karbon döngüsü atmosfer, litosfer, hidrosfer ve biyosfer arasında gerçekleşir. Döngü bozulmadığı sürece doğada karbon denge halindedir. Atmosferdeki CO2 miktarı bellidir. Havadan alınan co2 tekrar verilmemiş olsa idi fotosentez giderek azalacak ve 35 yıl gibi bir süre sonra besin zinciri durarak dünyada hayat kalmayacaktı. İnsanın olumsuz etkisi ile atmosferdeki karbon dengesi bozulmaktadır. Çünkü sanayileşme ile birlikte atmosfere eklenen karbondioksit miktarı %25 artmıştır.
Dengenin bozulmasında;
Atmosferdeki karbon dioksit ile sudaki karbon dioksit denge halindedir. Karbondioksitin karadaki doğal kaynağı yanardağlardır. Hızlı sanayileşme, kentleşme ve nüfus arştı ile insan fosil yakıtları gömülü oldukları yerden çıkararak fazla kullanmaktadır. Kömür, doğal gaz ve petrol gibi fosil yakıtların ve kireç taşının yakılması sonucunda atmosfere atılan karbon dioksit miktarı artmaktadır.
Yeryüzündeki doğal bitki örtüsünün azalması da (orman yangınları gibi sebeplerle) karbon dengesini önemli ölçüde etkiler. Bu durum insan eliyle atmosferdeki karbon dengesinin bozulabileceğini göstermektedir. Atmosferde artan karbondioksit miktarı yeryüzü sıcaklığının birkaç derece artmasına neden olacaktır. Yeryüzü giderek ısınacak, kutuplardaki buzulların erimesiyle deniz seviyesi yükselecek ve dünya iklimi değişecektir.
Doğada Karbondioksit Tüketimi;
1-Kara ve deniz bitkilerince fotosentezde kullanılır.
2- Deniz hayvanlarının kabuk oluşumunda kullanılır.
3- Deniz hayvanları ve bitkilerinin ölmesi tabana çökerek karbonatlı kayaların oluşumunda tüketilir.
4-Ölen canlıların bünyelerindeki karbon zamanla basıncın etkisiyle petrol, kömür gibi fosil yakıtlara dönüşür.
Doğada Karbondioksit açığa çıkması;
1-Canlıların solunumları sonucu doğaya döner.
2-Ölen canlıların çürümesi,
3-Orman yangınları,
4-Karbonatlı kayaların fiziksel ve kimyasal olarak ayrışması,
5-Suyun hava ile teması ile karbon havadan suya, sudan havaya geçer.
6-Volkanizma olayları sonucunda,
7-Fosil yakıtların yakılması,
AZOT DÖNGÜSÜ
Azotun doğada en bol olarak bulunduğu yerler;
1.Atmosfer,
2.Canlıların yapısı (Canlı vücudunda Proteinlerin, Nükleik asitlerin, çeşitli hormonların ve vitaminlerin yapısında bulunur.)
Azotun asıl kaynağı atmosferdir. Atmosfer %78 oranında azot (N2) içerir. Bazı mikroorganizmalar hariç canlılar azot gazını doğrudan doğruya kullanamazlar.
www.fenci.gen.tr/Moduller/Gallery/Goster.asp?...
Azotun bitkiler tarafından kullanabilmesi için bazı süreçlerden geçerek nitrit ve nitratlara dönüştürülmesi veya bağlanması gerekir. Azot bitkiler tarafından inorganik nitrat(NO3)- , bazı bitkiler tarafından da amonyum tuzları(NH4)+ hâlinde kullanılır. Hayvanlar azot ihtiyaçlarını beslenme yoluyla diğer bitki ve hayvanlardan karşılarlar. Ayrıca azot topraktaki verimi oldukça etkiler.
Resmin büyük hali için TIKLAYINIZ..
Azotun doğadaki dolaşımı:
1-Atmosferde yıldırım ve volkanik faaliyetler sırasında ortaya çıkan elektrik deşarjları gibi atmosferik olaylar sonucunda azot oksijen ile birleşerek nitratlara dönüşür. Bu nitratlar yağışlarla yere inerek toprağa karışır. Bitkiler tarafından alınır duruma getirilir
2- Azotun toprağa bağlanması topraktaki bazı bakteriler tarafından gerçekleştirilir.( örneğin fasulye ve bezelye gibi bitkilerin köklerinde yaşayan bakteriler) Tüm canlıların ölüleri ve atıklarındaki proteinler parçalanarak önce amino grup asitlere, sonra amonyağa dönüştürülür. Amonyak, nitrit bakterileri ile nitrit tuzlarına, nitrit tuzları nitrat bakterileri ile nitrat tuzlarına dönüştürülür.
3-Atmosferdeki azot ise baklagillerin köklerindeki azot bağlayıcı bakteriler tarafından nitrat tuzlarına dönüştürülür. Nitrat tuzları bitkilerin kökleriyle alınır, fotosentez sonucunda bitkisinin yapısına katılır.
4-Azot besin zinciri yoluyla bitkilerden otçullara, onlardan etçillere geçer.
5- Tüm canlıların ölüleri ve atıklarındaki proteinler ayrıştırıcılar tarafından parçalanır. Çeşitli mikroorganizmaların ve bakterilerin de etkisiyle azotun bir kısmı suda çözünmüş nitrat tuzları şeklinde toprakta kalır. Bir kısmı da azot gazına indirgenmiş olarak yeniden atmosfere döner. Bu şekilde azot döngüye katılmış olur.
Not: İnsanlarda azot döngüsünü de olumsuz etkilemektedir. Havadaki azot geliştirilen teknoloji sayesinde yapay gübre yapımında kullanılır. Yapay gübrenin tarımda verimi arttırmak için fazla kullanılması toprağın doğal özelliklerinin kaybolmasına neden olur. Dolayısıyla çevrede bitkilerce kullanılabilir azot eksikliği, insanlar açısından da beslenme yetersizliği ve açlık sorununu gündeme getirmektedir.
OKSİJEN DÖNGÜSÜ
Canlıların aldıkları besinleri enerjiye dönüştürebilmeleri için oksijen gereklidir. Atmosferde % 21 civarında oksijen bulunur. Oksijen doğada üç şekilde O, O2, O3 olarak bulunur. Atmosferde serbest halde moleküler oksijen (O2) Şeklinde bulunur. Çok reaktif bir gaz olduğu için çeşitli elementlerle birleşir.
Ozon her zaman atmosferde bulunmaz güneşten gelen ultraviyole ışınları ve yıldırım etkisiyle O2 nin O3 e dönüşmesi ile oluşur. Atmosferin Zaralı ışınları süzen filtresi durumundadır.
Oksijenin kaynakları:
1-Atmosfere en önemli oksijen sağlayan kaynak yeşil bitki ve alglerin fotosentez sonucunda kullandığı CO2 yerine oksijen vererek oksijen döngüsü gerçekleştirmelerdir. Canlılar tarafından solunumunda kullanılır ve karbondioksite dönüştürülür. Bu olayı denizlerde algler gerçekleştirir. Dünyamızdaki oksijenin % 90’lık kısmını algler sağlar. Ayrıca oksijen, ultraviyole ışınları etkiyle ozona dönüşür.
2-Atmosfere oksijen sağlayan bir başka kaynakta atmosferdeki suyun ışık yardımıyla oksijen ve hidrojene ayrışması sonucu açığa çıkan oksijendir.(Fotoliz)
Resmin büyük hali için TIKLAYINIZ
Atmosferdeki oksijen tüketimi: Solunum, Yakıt madenlerin yanmasında, organik maddelerin oksidasyonunda (besinlerin yakılmasında) kullanılır. Dünyada oksijen miktarında henüz önemli bir değişiklik olmamıştır. Oksijen döngüsü denk kapanmıştır.
FOSFOR DÖNGÜSÜ
Fosfor;
1.Canlılarda, dişlerin, kemiklerin ve nükleik asitlerin (DNA-RNA) yapısında bulunur.
2.Doğadaki fosfat kaynakları ise yer kabuğundaki fosfatlı kayalar ve denizler fosfor kaynağıdır.
Bu döngünün temeli fosforun karalarda denizlere denizlerden de karalara taşınmasıdır. Kayalardaki fosforun bir kısmı yağmur ve erozyon etkisiyle çözünerek suya karışır. Sudaki fosfor bitkiler tarafından alınır ve fosforlu bileşikler dönüştürülür. Besin zinciri yoluyla hayvanlara geçer. Bitki ve hayvan atıklarından ayrıştırıcılar tarafından tekrar inorganik fosfata dönüştürülerek bitkiler tarafından kullanılır. Denizlerdeki fosfor denizlerdeki bitki ve hayvanların ihtiyacını karşılar. Balıklarla ya da suda avlanan kuşların dışkıları ile tekrar karaya taşınır.
Fosfatlı kayalar işlenerek yapay gübre elde edilir. Yapay gübre olarak toprağa atılan fosfor, toprak erozyonu ile akarsulara, oradan da tekrar denizlere sürüklenir. Böylece fosforun karalardan denizlere dönüşü hızlandırılmış olur. İnsanların bu ve benzeri faaliyetleri ise fosfor kaynaklarının tükenmesine yol açabilir.
KÜKÜRT DÖNGÜSÜ
Kükürt,toprakta ve proteinlerin yapısında bol miktarda bulunur. Fakat bitkiler kükürdü sülfatlara çevrildikten sonra kullanabilirler. Kükürt içeren proteinler,önce topraktaki çeşitli organizmalar aracılığıyla kendilerini oluşturan aminoasitlere parçalanır,ardından amino asitlerdeki kükürt başka bir dizi toprak mikroorganizması yardımıyla hidrojen sülfüre dönüşür.Hidrojen sülfür oksijenli ortamda,kükürt bakterileri aracılığıyla önce kükürde sonra sülfata çevrilir;sülfatlar da başka bakteriler tarafından yeniden hidrojen sülfüre dönüşür.Eğer bitki veya hayvan ölürse,yapılarındaki proteinin parçalanmasıyla kükürt H S şeklinde açığa çıkar.H S kükürt bakterileri tarafından önce S O‘ye daha sonra da Oiyonuna dönüştürülür.SO iyonları,bazen doğada serbest olarak reaksiyona girerek sülfatlı bileşikleri de verebilirler.Organizmalar tarafından alındığı takdirde kükürt içeren iki aminoasit olan Sistein ve Metionin’nin yapısına katılırlar.
MADDE DÖNGÜLERİNİN YARARLARI
Tüm canlılar dünyanın yüzeyinde ya da yüzeye çok yakın ince bir toprak katmanında yaşarlar ve güneş enerjisinin dışındaki gereksinimlerini bu katmanın içerdiği kaynaklardan karşılarlar. Eğer yaşamın sürmesi için gerekli olan su,oksijen ve diğer maddeler sadece bir kez kullanılmış olsaydı hepsi şimdiye kadar tükenmiş olurdu.
Doğanın tüm işlevlerinin çevrimler halinde düzenlenmiş olması bu işlevlerin sonsuza dek yinelenmesini sağlamaktadır.Hava,su,toprak,bitkiler ve hayvanlar arasında sürekli bir alışveriş olması yeryüzünün tüm zenginliklerinin tekrar tekrar kullanılabilmesine ve böylelikle yaşamın sürmesine olanak verir.
KONU İLE İLGİLİ TAVSİYELER:Genel olarak karışık bir konu gibi gözüksede unutulmamalıdır ki doğada madde yok olmaz sürekli dönüşüm halindedir.Burdan yola çıkarak şekilleri anlamaya çalışmak ezberden ziyade daha kalıcı bilgiler sağlar.Kendinize küçük kavram haritaları oluşturarak öncelikle maddenin bulunduğu ortam ,hangi hallerde arttığı,hangi hallerde azaldığı şeklinde döngüler konusunu öğrenmeye çalışırsanız kalıcılık sağlar.Örneğin oksijen döngüsünde oksijen oluşumu ve oksijenin üretim şekli düşünülerek (fotosentez ve suyun parçalanarak oksije oluşturması) tüketim olarak solunum maden ve besinlerin yakılması şeklinde öğrenmeniz işinizi kolaylaştırabilir.Yoksa bu kadar döngü ve özelliklerini hafızaya almak ezbercilikten öteye gitmez.Kitabınızdaki şekilli alanlar direk yazılı sorusu konuları olabilir.Örnek vermek gerekirse hangi döngü olayında nitrit ve nitratlara dönüşüm olayı söz konusudur gibi.Yıldırım olayı hangi döngü oluşumunda etkilidir.Aşağıdaki olaylardan hangisinde oksijen açığa çıkar yada çıkmaz.Yada aynı soru diğer döngüler için sorulabilir.
GERİ DÖNÜŞÜM
Geri dönüşüm terim olarak, kullanım dışı kalan geri dönüştürülebilir atık malzemelerin çeşitli geri dönüşüm yöntemleri ile hammadde olarak tekrar imalatsüreçlerine kazandırılmasıdır.
Tüketilen maddelerin yeniden geri dönüşüm halkası içine katılabilmesi ile öncelikle hammadde ihtiyacı azalır. Böylece insan nüfusunun artışı ile paralel olarak artan tüketimin doğal dengeyi bozması ve doğaya verilen zarar engellenmiş olur. Bununla birlikte yeniden dönüştürülebilen maddelerin tekrar hammadde olarak kullanılması büyük miktarda enerji tasarrufunu mümkün kılar. Örneğin, yeniden kazanılabilir alüminyumun kullanılması alüminyumun sıfırdan imal edilmesine oranla %35'e varan enerji tasarrufu sağlamaktadır.
Atık malzemelerin hammadde olarak kullanılması çevre kirliliğinin engellenmesi açısından da önemlidir. Kullanılmış kağıdın tekrar kâğıt imalatında kullanılması havakirliliğini %74-94, su kirliliğini %35, su kullanımını %45 azaltabilmektedir. Örneğin bir ton atık kağıdın kâğıt hamuruna katılmasıyla 8 ağacın kesilmesi önlenebilmektedir.


Geri dönüşümün tarihçesi
Geri dönüşüme olan ihtiyacın başlamasında savaşlar nedeniyle ortaya çıkan kaynak sıkıntıları etkili olmuştur. Büyük devletler, II. Dünya Savaşı sırasında ülke çapında geri dönüşümle ilgili kampanyalar başlatmışlardır. Vatandaşlar özellikle metal ve fiber maddeleri toplama konusunda teşvik edilmişlerdir.ABD'de geri dönüşüm işlemi yurtseverlik anlayışında çok önemli bir yer edinmiştir. Hatta, savaş sırasında oluşturulan kaynak koruma programları, doğal kaynakları kısıtlı bazı ülkelerde (Japonya gibi), savaş sonrası da devam ettirilmiştir.
Geri dönüşebilen maddeler
- Kimyasal atıklar
- Cam
- Kağıt
- Alüminyum
- Plastik
- Piller
- Motor yağı
- Akümülatörler
- Beton
- Organik atıklar
- Elektronik atıklar
- Demir
- Tekstil
- Ahşap
- Metal
Geri dönüşüm sembolleri ve kodları
Bazı maddelere ait geri dönüşüm sembol ve kodları aşağıda verilmiştir. Bu semboller uluslararası olarak kullanılır.
Geri dönüştürme metotları
Geri dönüştürme metodları her malzeme için farklılık göstermektedir:
- Alüminyum: Atık alüminyum küçük parçacıklar halinde doğranır. Daha sonra bu parçalar büyük ocaklarda eritilerek, dökme alüminyum üretilir. Bu sayede atık alüminyum, saf alüminyum ile neredeyse aynı hale gelir ve üretimde kullanılabilir. 1 ton metal atığın geri dönüştürülmesi sonucunda 1300 kg hammade tasarrufu sağlanır. Örneğin; Türkiye'de yıllık olarak toplam 2 milyon tona ulaşmaktadır.
- Beton: Beton parçalar, yıkım alanlarından toplanarak kırma makinalarının bulunduğu yerlere getirilir. Kırma işleminden sonra ufak parçalar, yeni işlerde çakıl olarak kullanılır. Parçalanmış beton, eğer içeriğinde katkı maddeleri yoksa yeni beton için kuru harç olarak da kullanılabilir.
- Kağıt: Kağıt öncelikle kâğıt çamuru hazırlamak için, su içerisinde liflerine ayrılır. Eğer gerekirse içindeki lif olmayan yabancı maddeler için temizleme işlemine tutulur. Mürekkep ayırıcı olarak, sodyum hidroksit veya sodyum karbonat kullanılır. Daha sonra hazır olan kâğıt lifleri, geri dönüşmüş kâğıt üretiminde kullanılır. 1 ton kullanılmış kâğıt atığının geri dönüşümü sonucunda, 16 adet yetişmiş çam ağacı ve 85 metrekarelik ormanlık alan tahrip edilmeyecektir. Örneğin; Türkiye genelinde yılda 80 milyon çam ağacı ve 40.000 hektar ormanlık arazi korunmuş olabilecektir.
- Plastik: Plastik atıklar öncelikle cinslerine göre ayrılarak geri dönüşüm işlemine tabi tutulur. Cinslerine göre ayrılan geri dönüşebilir plastik atıklar, kırma makinalarında kırılıp küçük parçalara ayrılır. İşletmeler bu parçaları doğrudan belli oranlarda, orijinal hammadde ile karıştıraraküretim işleminde kullanabildiği gibi; tekrar eritip katkı maddeleri katarak ikinci sınıf hammadde olarak da kullanabilir. 1 ton plastik ambalaj atığının geri dönüşümü sonucunda 14000 kWh enerji tasarrufu sağlanmış olur. Örneğin; Türkiye genelinde tasarruf edilebilecek enerji miktarı yıllık 4 Milyon Megawatt saattir (MWh).
- Cam: Cam atıklar (şişe, kavanoz vb.) toplama kutularında toplanır ve bu atıklar renklerine göre ayrılarak geri dönüşüm tesislerine verilir. Burada atık ve katkı maddelerinden ayrılır. Burada cam kırılır ve hammadde karışımına karıştırılarak eritme ocaklarına dökülür. Bu şekilde tekrar cam olarak kullanıma geçer. Kırılan cam, beton katkısı ve camasfalt olarak da kullanılmaktadır. Camasfalta %30 civarında geri dönüşmüş cam katılmaktadır. Cam bu şekilde sonsuz bir döngü içinde geri dönüştürülebilir, yapısında bozulma olmaz. 1 ton cam atığının geri dönüşümü sonucu 100 litre benzin tasarrufu sağlanmaktadır. Örneğin; Türkiye genelindeki cam atıkların geri dönüştürülmesinden yıllık 30 milyon litre benzin tasarruf edilebilecektir.
KAYNAKÇALAR VİKİPEDİA VE FENOKULU.NET